職位推薦
- 珍格醫(yī)療-臨床銷售 15001-20000
- 地奧制藥-醫(yī)藥代表 6001-8000
- 普利德醫(yī)療-醫(yī)療設(shè)備銷售經(jīng)理 面議
- 大唐-兼職招商經(jīng)理 面議
- 景德中藥-直營經(jīng)理 6001-8000
- 安邦醫(yī)藥-省區(qū)招商經(jīng)理 8001-10000
- 恒瑞醫(yī)藥-醫(yī)藥信息溝通專員 6001-8000
- 黃河中藥-學(xué)術(shù)講師 8001-10000

發(fā)布日期:2024-12-19 瀏覽次數(shù):97
2024年第47屆圣安東尼奧乳腺癌研討會(SABCS)于12月10日至13日在美國圣安東尼奧舉行。期間,復(fù)旦大學(xué)附屬腫瘤醫(yī)院李俊杰教授在全體大會環(huán)節(jié)(General Session)中以口頭報(bào)告的形式發(fā)布了“HER2靶向抗體偶聯(lián)藥物(ADC)SHR-A1811(注射用瑞康曲妥珠單抗)在HER2陽性早期乳腺癌新輔助治療中的研究:一項(xiàng)前瞻性、隨機(jī)、開放標(biāo)簽、Ⅱ期試驗(yàn)”(GS1-04)的數(shù)據(jù)。該研究結(jié)果表明[1],SHR-A1811在HER2陽性早期乳腺癌新輔助治療中,顯示出有前景的抗腫瘤活性和可管理的安全性,為優(yōu)化HER2陽性乳腺癌新輔助治療策略提供了新思路。
2024 SABCS現(xiàn)場圖:李俊杰教授在現(xiàn)場進(jìn)行口頭報(bào)告
01研究背景
新輔助治療常規(guī)推薦用于Ⅱ期和Ⅲ期HER2陽性乳腺癌(HER2+BC) 。抗體偶聯(lián)藥物(ADCs)在HER2陽性轉(zhuǎn)移性乳腺癌中表現(xiàn)出顯著的療效[2-5]。抗HER2 ADCs也在新輔助治療領(lǐng)域中探索。
SHR-A1811(注射用瑞康曲妥珠單抗)是恒瑞醫(yī)藥自主研發(fā)的、以HER2為靶點(diǎn)的抗體藥物偶聯(lián)物,擬用于HER2表達(dá)或突變的晚期實(shí)體瘤的治療。SHR-A1811可特異性結(jié)合腫瘤細(xì)胞表面上的HER2,隨后偶聯(lián)物被內(nèi)吞至細(xì)胞內(nèi)并轉(zhuǎn)運(yùn)至溶酶體中,通過攜帶的載藥在腫瘤細(xì)胞內(nèi)產(chǎn)生藥物作用,誘導(dǎo)腫瘤細(xì)胞的凋亡。在SHR-A1811用于經(jīng)多線治療的HER2過表達(dá)或突變的晚期實(shí)體瘤的國際I期研究中,SHR-A1811表現(xiàn)出有前景的抗腫瘤活性和可控的安全性[6]。此I期研究于2024年SABCS會議更新生存隨訪數(shù)據(jù),HER2陽性乳腺癌中位無進(jìn)展生存期(mPFS)達(dá)20個(gè)月,客觀緩解率(ORR)達(dá)79.1%;HER2低表達(dá)乳腺癌mPFS達(dá)11個(gè)月,ORR達(dá)62.0%;僅在2.6%患者中發(fā)生間質(zhì)性肺病[7]。
02研究方法
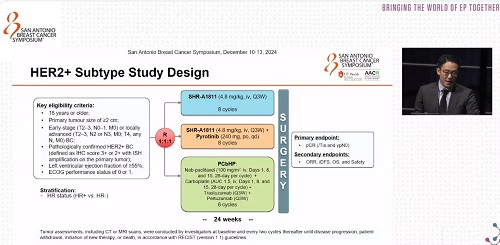
這是一項(xiàng)開放標(biāo)簽、隨機(jī)、Ⅱ期臨床研究,共納入了265例年齡≥18歲、臨床分期為Ⅱ/Ⅲ期的HER2陽性早期或局晚期乳腺癌患者。患者按1:1:1的比例隨機(jī)分配至以下三組:
● SHR-A1811單藥組:接受SHR-A1811單藥治療(4.8mg/kg,第1天,每3周靜脈滴注一次),共8個(gè)周期;
● SHR-A1811聯(lián)合吡咯替尼組:接受SHR-A1811聯(lián)合吡咯替尼(240mg,每日口服一次),共8個(gè)周期;
● PCbHP組:接受白蛋白紫杉醇(100mg/m2,第1天、第8天和第15天靜脈滴注,每28天為一個(gè)周期)聯(lián)合卡鉑(AUC 1.5,第1天、第8天和第15天靜脈滴注,每28天為一個(gè)周期)、曲妥珠單抗(首次劑量8mg/kg,后續(xù)劑量6mg/kg,每3周靜脈滴注一次)和帕妥珠單抗(首次劑量840mg,后續(xù)劑量420mg,每3周靜脈滴注一次),共6個(gè)周期。
研究主要終點(diǎn)為意向治療人群(ITT)的病理完全緩解(pCR,ypT0/is ypN0)。次要終點(diǎn)包括ORR、無侵襲性疾病生存期(iDFS)、總生存期(OS)和安全性。
圖1. HER2+亞型的研究設(shè)計(jì)
03研究結(jié)果
共有265例患者被隨機(jī)分配,87例至SHR-A1811單藥組,88例至SHR-A1811聯(lián)合吡咯替尼組,90例至PCbHP組。治療組之間的基線特征相似,約55%為激素受體(HR)陰性,90%為淋巴結(jié)陽性,70%為Ⅲ期(表1)。

表1. 患者和腫瘤基線特征
1.有效性結(jié)局
SHR-A1811單藥組的pCR率為63.2%(HR陽性為50.0%,HR陰性為74.5%),SHR-A1811聯(lián)合吡咯替尼組的pCR率為62.5%(HR陽性為44.7%,HR陰性為76.0%),PCbHP的pCR率為64.4%(HR陽性為54.1%,HR陰性為71.7%),各組之間pCR無顯著差異(圖2)。

圖2. 療效分析pCR
pCR亞組分析:SHR-A1811單藥或聯(lián)合吡咯替尼組未觀察到明顯獲益趨勢的亞組(圖3)。

圖3. pCR亞組分析
探索性分析:SHR-A1811單藥、SHR-A1811聯(lián)合吡咯替尼組和PCbHP組的腫瘤退縮率相當(dāng),分別為87.4%(C8)、87.2%(C8)、84.0%(C6),見圖4。

圖4. 腫瘤退縮率
2.安全性
SHR-A1811在HER2陽性乳腺癌新輔助治療中,毒性總體安全可控。
04總結(jié)
本研究首次評估了抗HER2 ADC SHR-A1811在HER2陽性乳腺癌新輔助治療中的療效,SHR-A1811顯示出有前景的抗腫瘤活性和可管理的安全性,SHR-A1811單藥治療pCR率高達(dá)63.2%,腫瘤退縮率達(dá)到87.4%,且毒性安全可控。證實(shí)SHR-A1811治療具有潛在的臨床應(yīng)用價(jià)值,為優(yōu)化HER2陽性乳腺癌新輔助治療策略提供了新思路,值得進(jìn)一步臨床研究探索。
05展望
“ADC+”聯(lián)合治療策略可有望最大程度地發(fā)揮ADC藥物的抗腫瘤作用。抗血管生成藥物、抗HER2藥物(單抗、TKIs等)、PARP抑制劑和免疫檢查點(diǎn)抑制劑等藥物與ADC聯(lián)合是目前探索的熱門方向。我們期待看到更多關(guān)于ADC聯(lián)合治療的創(chuàng)新性研究,通過基因測序、蛋白質(zhì)組學(xué)等手段更準(zhǔn)確地評估患者的腫瘤特征,篩選出最可能從聯(lián)合治療中獲益的患者,從而為乳腺癌患者制定個(gè)性化的治療方案,以提高療效。
參考文獻(xiàn):
[1] 2024 SABCS GS1-04.
[2] N Engl J Med. 2012;367(19):1783-91.
[3] N Engl J Med 2020; 382(7): 610-21.
[4] André F, et al. Lancet 2023; 401(10390): 1773-85.
[5] N Engl J Med. 2022;386(12):1143-54.
[6] J Clin Oncol. 2024;42(29):3453-65.
[7] Herui Yao, et al. 2024 SABCS. PS8-08.
300多萬優(yōu)質(zhì)簡歷
17年行業(yè)積淀
2萬多家合作名企業(yè)

微信掃一掃 使用小程序
